摘要:CiRA的Shin Kaneko實驗室開發(fā)了一種從iPS細胞(iCAR-T細胞)中生成CAR-T細胞的方法,這種細胞在實體瘤小鼠模型中具有極大的抗腫瘤活性。
為了在實體腫瘤的免疫治療中有效地使用表達嵌合抗原受體(CAR)的T細胞,靜脈注射CAR-T細胞在腫瘤部位積聚和增殖是至關(guān)重要的,在那里它們將持續(xù)工作,靶向并消除有害的癌細胞。
由Kaneko教授和Tatsuki Ueda博士(前CiRA研究員,現(xiàn)就職于芝加哥大學(xué))領(lǐng)導(dǎo)的研究小組首先研究了不同的CAR結(jié)構(gòu)是否會影響iPS細胞來源的造血祖細胞向T細胞的分化,并最終選擇了一種對分化效率沒有任何負面影響的CAR結(jié)構(gòu)。
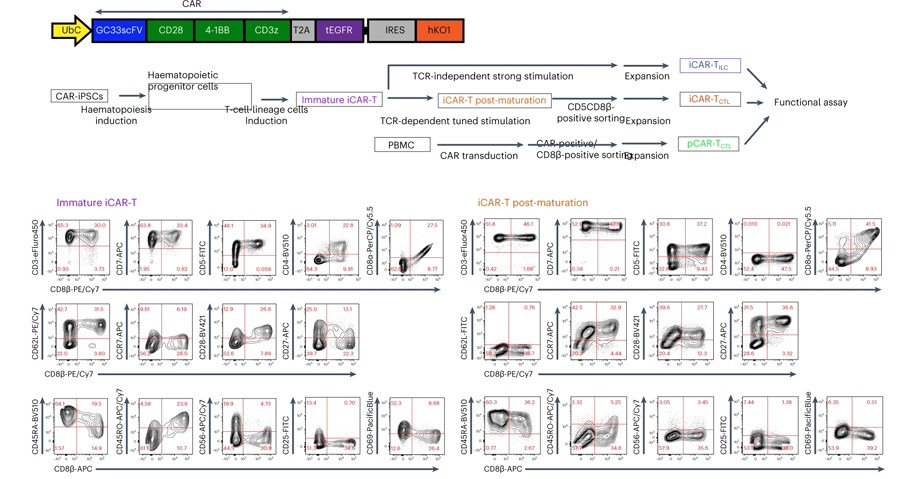
圖1 iCAR-TCTL在體內(nèi)抑制腫瘤發(fā)展并聚集在腫瘤位點強于iCAR-TILC但不及pCAR-TCTL(圖源:[1])
接下來,該團隊成功地在實體腫瘤小鼠模型中展示了這些iCAR-T細胞的兩個額外的遺傳操作——旨在增強T細胞的激活——增強了它們在腫瘤部位的增殖,并延長了它們的生存時間,比以往任何時候都要長。引人注目的是,改良后的iCAR-T細胞抑制了腫瘤生長,并延長了受體動物的生存時間,即使只注射了原始劑量的1/20的未經(jīng)改良的iCAR-T細胞。
Kaneko團隊設(shè)計的這些修改有望使長期以來備受期待的ipsc衍生CAR-T細胞用于實體腫瘤治療的實際應(yīng)用更接近現(xiàn)實。
該研究結(jié)果于2022年12月12日在線發(fā)表在《Nature Biomedical Engineering》雜志上。

圖2 人誘導(dǎo)多能干細胞CAR T細胞增殖和持久性的優(yōu)化(圖源:[2])
參考資料:
[1] Optimization of the proliferation and persistency of CAR T cells derived from human induced pluripotent stem cells
摘要:CiRA的Shin Kaneko實驗室開發(fā)了一種從iPS細胞(iCAR-T細胞)中生成CAR-T細胞的方法,這種細胞在實體瘤小鼠模型中具有極大的抗腫瘤活性。
為了在實體腫瘤的免疫治療中有效地使用表達嵌合抗原受體(CAR)的T細胞,靜脈注射CAR-T細胞在腫瘤部位積聚和增殖是至關(guān)重要的,在那里它們將持續(xù)工作,靶向并消除有害的癌細胞。
由Kaneko教授和Tatsuki Ueda博士(前CiRA研究員,現(xiàn)就職于芝加哥大學(xué))領(lǐng)導(dǎo)的研究小組首先研究了不同的CAR結(jié)構(gòu)是否會影響iPS細胞來源的造血祖細胞向T細胞的分化,并最終選擇了一種對分化效率沒有任何負面影響的CAR結(jié)構(gòu)。

圖1 iCAR-TCTL在體內(nèi)抑制腫瘤發(fā)展并聚集在腫瘤位點強于iCAR-TILC但不及pCAR-TCTL(圖源:[1])
接下來,該團隊成功地在實體腫瘤小鼠模型中展示了這些iCAR-T細胞的兩個額外的遺傳操作——旨在增強T細胞的激活——增強了它們在腫瘤部位的增殖,并延長了它們的生存時間,比以往任何時候都要長。引人注目的是,改良后的iCAR-T細胞抑制了腫瘤生長,并延長了受體動物的生存時間,即使只注射了原始劑量的1/20的未經(jīng)改良的iCAR-T細胞。
Kaneko團隊設(shè)計的這些修改有望使長期以來備受期待的ipsc衍生CAR-T細胞用于實體腫瘤治療的實際應(yīng)用更接近現(xiàn)實。
該研究結(jié)果于2022年12月12日在線發(fā)表在《Nature Biomedical Engineering》雜志上。

圖2 人誘導(dǎo)多能干細胞CAR T細胞增殖和持久性的優(yōu)化(圖源:[2])
參考資料:
[1] Optimization of the proliferation and persistency of CAR T cells derived from human induced pluripotent stem cells



