摘要:近期的一項綜合調(diào)查表明,過去30年的研究主要集中于某些生物學(xué)通路(特別是免疫和代謝通路),但還有數(shù)百條通路與這種疾病有關(guān)。
阿爾茨海默病(AD)是一種復(fù)雜的神經(jīng)退行性疾病。多年來,阿爾茨海默病的研究主要專注于少數(shù)病理改變,比如大腦中tau蛋白和β-淀粉樣蛋白的異常積累。近期的一項綜合調(diào)查表明,過去30年的研究主要集中于某些生物學(xué)通路(特別是免疫和代謝通路),但還有數(shù)百條通路與這種疾病有關(guān)。
哈佛醫(yī)學(xué)院醫(yī)學(xué)副教授Winston A. Hide博士領(lǐng)導(dǎo)的團(tuán)隊開展了這一調(diào)查,并將結(jié)果發(fā)表在《Frontiers in Aging Neuroscience》雜志上。他認(rèn)為,阿爾茨海默病研究就像一艘超級巨輪,改變其航向和速度需要付出的努力,但這種需求是不可避免的。
“令我震驚的是,盡管過去幾十年來對相同的25條或30條通路進(jìn)行了深入研究,但這些研究并沒有帶來遺傳或功能發(fā)現(xiàn),”Hide博士說。他認(rèn)為,對單個基因或單條通路的不懈追求幾乎沒有找到有效的治療方法,強(qiáng)調(diào)需要開始思考通路組合與其表型之間的關(guān)系。

圖1 阿爾茨海默病研究的生物學(xué)通路數(shù)以百計(圖源:[1])
令人沮喪的信號
在這項研究中,研究人員對1990年以來發(fā)表的20多萬篇文獻(xiàn)進(jìn)行了系統(tǒng)評估,以了解與AD相關(guān)的生物學(xué)通路的廣泛性和多樣性。然而,AD關(guān)聯(lián)通路的普遍存在令研究團(tuán)隊感到既驚訝又沮喪。在至少五篇文獻(xiàn)中,幾乎所有的通路(91%)都與AD相關(guān),在100多篇文獻(xiàn)中,近一半的通路與之相關(guān)。
Hide博士表示,與癡呆關(guān)聯(lián)度較高的通路包括阿爾茨海默病、帕金森病、免疫系統(tǒng)、代謝通路、膽堿能突觸、長期抑郁、糖尿病等。他指出,膽汁酸分泌(膽固醇代謝的產(chǎn)物)一次又一次地作為AD相關(guān)通路出現(xiàn),但這與大腦中的神經(jīng)退行性病變有什么關(guān)系呢?“這些是我們需要提出的問題。”
對抗AD的通路
他認(rèn)為,可以根據(jù)患者體內(nèi)“對抗AD的通路”將患者分為不同的亞組。顯然,大腦中的斑塊水平并不是分類標(biāo)準(zhǔn)。“有些人大腦中的AD病理特征很嚴(yán)重,但他們并沒有生病。他們可以正常地思考。”
在近期發(fā)表于《Acta Neuropathologica》(DOI: 10.1007/s00401-022-02467-8)的一份病例報告中,研究人員描述了一名有早發(fā)性阿爾茨海默病家族史的女性,她在70多歲時仍沒有癡呆癥,似乎受到APOE3突變的保護(hù)。在APOE基因家族中,APOE3是常見的變異,但通常與AD風(fēng)險的升高或降低無關(guān)。
還有一些人的大腦中也有AD的病理特征,但似乎沒有喪失認(rèn)知功能。這些人成功抵御了這種疾病。“與其去尋找可去除的蛋白質(zhì),我們?yōu)槭裁床蝗プ屑?xì)找找人體本身采用哪些機(jī)制來抵御阿爾茨海默病呢?”Hide博士說。
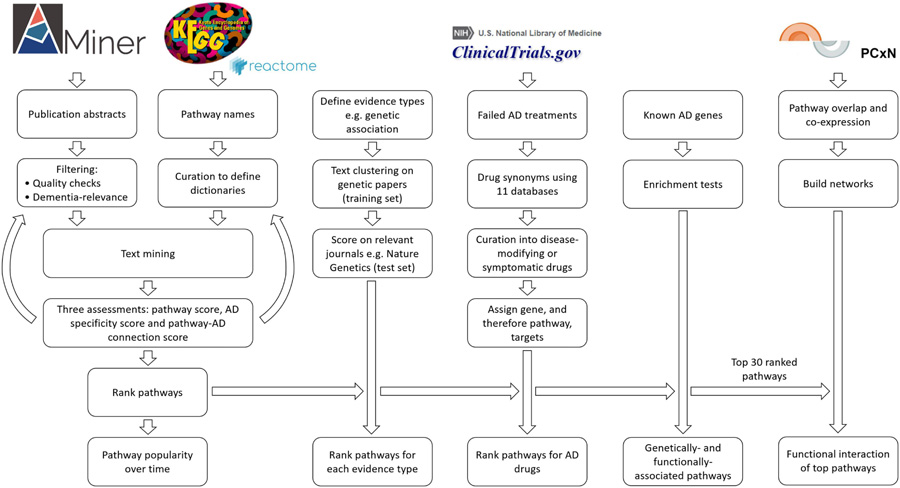
圖2 概述“阿爾茨海默癥”或“癡呆癥”研究方法的流程(圖源:[1])
改變航向
Hide博士及其同事現(xiàn)在采用的方法是以每條通路作為功能單位(而不是基因)來獲得答案。他們很快就會發(fā)布一份新報告,說明在AD中共激活的通路亞群。有趣的是,他們已經(jīng)確定了約20條在AD患者中總是被激活的通路,而與他們的病理特征無關(guān)。
這種新穎的數(shù)據(jù)驅(qū)動方法將有助于選擇目標(biāo)通路。他表示,通路的普遍性不只是AD有,帕金森病、糖尿病和癌癥也存在相同的模式。因此,研究復(fù)雜疾病的科學(xué)家在開展藥物試驗時應(yīng)解決其分子機(jī)理。
“對于新一代的AD研究人員,我們需要向他們灌輸對教條的懷疑,因為過去的一些理論誤導(dǎo)了我們,”Hide博士說。“我們必須適應(yīng)阿爾茨海默病的艱難事實,才能推動這艘巨輪,使其到達(dá)治愈的終點。”
參考資料:
Morgan SL, Naderi P, Koler K, Pita-Juarez Y, Prokopenko D, Vlachos IS, Tanzi RE, Bertram L and Hide WA (2022) Most Pathways Can Be Related to the Pathogenesis of Alzheimer’s Disease. Front. Aging Neurosci. 14:846902. doi: 10.3389/fnagi.2022.846902
摘要:近期的一項綜合調(diào)查表明,過去30年的研究主要集中于某些生物學(xué)通路(特別是免疫和代謝通路),但還有數(shù)百條通路與這種疾病有關(guān)。
阿爾茨海默病(AD)是一種復(fù)雜的神經(jīng)退行性疾病。多年來,阿爾茨海默病的研究主要專注于少數(shù)病理改變,比如大腦中tau蛋白和β-淀粉樣蛋白的異常積累。近期的一項綜合調(diào)查表明,過去30年的研究主要集中于某些生物學(xué)通路(特別是免疫和代謝通路),但還有數(shù)百條通路與這種疾病有關(guān)。
哈佛醫(yī)學(xué)院醫(yī)學(xué)副教授Winston A. Hide博士領(lǐng)導(dǎo)的團(tuán)隊開展了這一調(diào)查,并將結(jié)果發(fā)表在《Frontiers in Aging Neuroscience》雜志上。他認(rèn)為,阿爾茨海默病研究就像一艘超級巨輪,改變其航向和速度需要付出的努力,但這種需求是不可避免的。
“令我震驚的是,盡管過去幾十年來對相同的25條或30條通路進(jìn)行了深入研究,但這些研究并沒有帶來遺傳或功能發(fā)現(xiàn),”Hide博士說。他認(rèn)為,對單個基因或單條通路的不懈追求幾乎沒有找到有效的治療方法,強(qiáng)調(diào)需要開始思考通路組合與其表型之間的關(guān)系。

圖1 阿爾茨海默病研究的生物學(xué)通路數(shù)以百計(圖源:[1])
令人沮喪的信號
在這項研究中,研究人員對1990年以來發(fā)表的20多萬篇文獻(xiàn)進(jìn)行了系統(tǒng)評估,以了解與AD相關(guān)的生物學(xué)通路的廣泛性和多樣性。然而,AD關(guān)聯(lián)通路的普遍存在令研究團(tuán)隊感到既驚訝又沮喪。在至少五篇文獻(xiàn)中,幾乎所有的通路(91%)都與AD相關(guān),在100多篇文獻(xiàn)中,近一半的通路與之相關(guān)。
Hide博士表示,與癡呆關(guān)聯(lián)度較高的通路包括阿爾茨海默病、帕金森病、免疫系統(tǒng)、代謝通路、膽堿能突觸、長期抑郁、糖尿病等。他指出,膽汁酸分泌(膽固醇代謝的產(chǎn)物)一次又一次地作為AD相關(guān)通路出現(xiàn),但這與大腦中的神經(jīng)退行性病變有什么關(guān)系呢?“這些是我們需要提出的問題。”
對抗AD的通路
他認(rèn)為,可以根據(jù)患者體內(nèi)“對抗AD的通路”將患者分為不同的亞組。顯然,大腦中的斑塊水平并不是分類標(biāo)準(zhǔn)。“有些人大腦中的AD病理特征很嚴(yán)重,但他們并沒有生病。他們可以正常地思考。”
在近期發(fā)表于《Acta Neuropathologica》(DOI: 10.1007/s00401-022-02467-8)的一份病例報告中,研究人員描述了一名有早發(fā)性阿爾茨海默病家族史的女性,她在70多歲時仍沒有癡呆癥,似乎受到APOE3突變的保護(hù)。在APOE基因家族中,APOE3是常見的變異,但通常與AD風(fēng)險的升高或降低無關(guān)。
還有一些人的大腦中也有AD的病理特征,但似乎沒有喪失認(rèn)知功能。這些人成功抵御了這種疾病。“與其去尋找可去除的蛋白質(zhì),我們?yōu)槭裁床蝗プ屑?xì)找找人體本身采用哪些機(jī)制來抵御阿爾茨海默病呢?”Hide博士說。

圖2 概述“阿爾茨海默癥”或“癡呆癥”研究方法的流程(圖源:[1])
改變航向
Hide博士及其同事現(xiàn)在采用的方法是以每條通路作為功能單位(而不是基因)來獲得答案。他們很快就會發(fā)布一份新報告,說明在AD中共激活的通路亞群。有趣的是,他們已經(jīng)確定了約20條在AD患者中總是被激活的通路,而與他們的病理特征無關(guān)。
這種新穎的數(shù)據(jù)驅(qū)動方法將有助于選擇目標(biāo)通路。他表示,通路的普遍性不只是AD有,帕金森病、糖尿病和癌癥也存在相同的模式。因此,研究復(fù)雜疾病的科學(xué)家在開展藥物試驗時應(yīng)解決其分子機(jī)理。
“對于新一代的AD研究人員,我們需要向他們灌輸對教條的懷疑,因為過去的一些理論誤導(dǎo)了我們,”Hide博士說。“我們必須適應(yīng)阿爾茨海默病的艱難事實,才能推動這艘巨輪,使其到達(dá)治愈的終點。”
參考資料:
Morgan SL, Naderi P, Koler K, Pita-Juarez Y, Prokopenko D, Vlachos IS, Tanzi RE, Bertram L and Hide WA (2022) Most Pathways Can Be Related to the Pathogenesis of Alzheimer’s Disease. Front. Aging Neurosci. 14:846902. doi: 10.3389/fnagi.2022.846902



